宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网www.bjtlcd.com化学平衡状态的特点
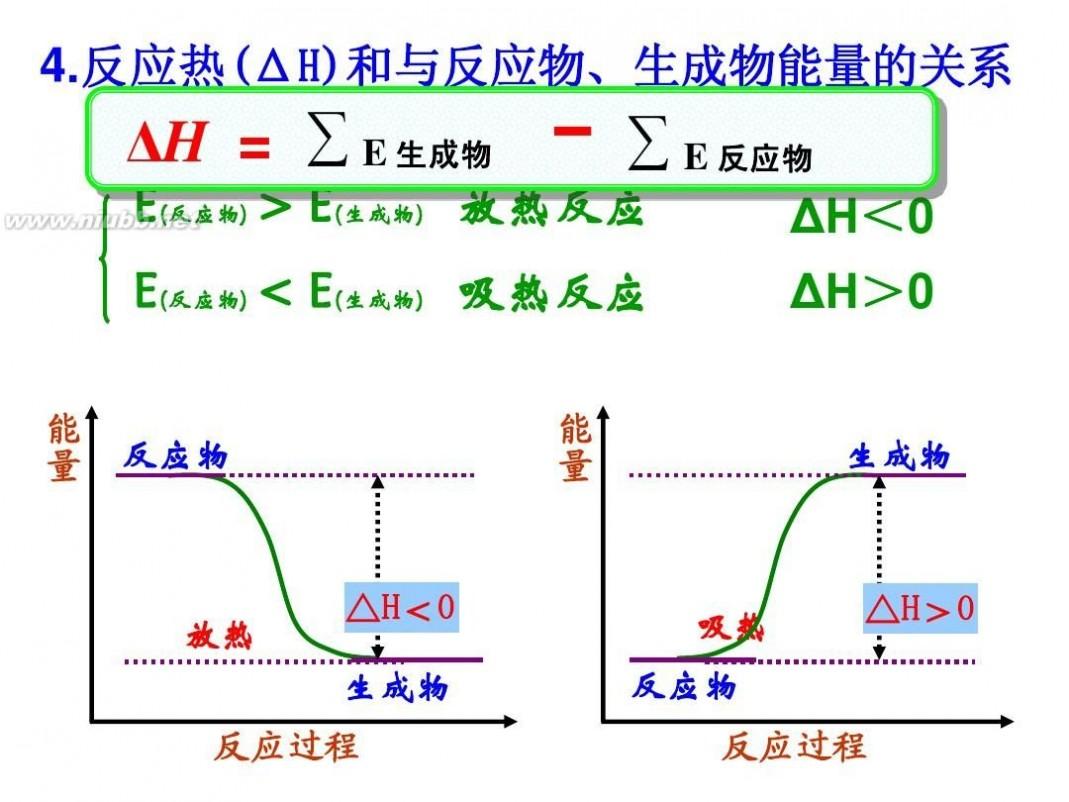
化学平衡状态具有逆,等,动,定,变、同六大特征。 逆:化学平衡研究的对象是可逆反应。 等:平衡时,正、逆反应速率相等,即v正=v逆。 动:平衡时,反应仍在进行,是动态平衡,反应进行到了最大限度。 定:达到平衡状态时,反应混合物中各组分的浓度保持不变,反应速率保持不变,反应物的转化率保持不变,各组分的含量保持不变。 变:化学平衡跟所有的动态平衡一样,是有条件的,暂时的,相对的,当条件发生变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建立新平衡,即化学平衡发生了移动。 同:一定条件下化学平衡状态的建立与反应的途径无关。即无论是从正反应开始,还是从逆反应开始,或是从任一中间状态开始建立,只要外界条件相同,达到平衡时的效果都相同。 如何判断化学反应达到平衡
1.同一物质的生成速率和分解速率相等 2.反应体系中各物质的物质的量或者浓度,百分含量,体积分数,质量分数,物质的量分数不再改变 3.同一物种化学键的断裂和形成数目相等 4.有气体参加反应,当反应前后气体总体积不等的时候 ,气体的平均相对分子质量,密度,压强不变 5.若反应为绝热体系,反应体系温度一定 6.转化率相同 7.若反应有颜色的改变,则颜色不变时平衡。 化学反应达到平衡状态标志 1.同一物质的生成速率和分解速率相等。 2.反应体系中各物质的物质的量或者浓度,百分含量,体积分数,质量分数,物质的量分数不再改变。 3.同一物种化学键的断裂和形成数目相等。 4.有气体参加反应,当反应前后气体总体积不等的时候,气体的平均相对分子质量,密度,压强不变。 5.若反应为绝热体系,反应体系温度一定。 6.转化率相同。 7.若反应有颜色的改变,则颜色不变时平衡。 化学平衡基本特征 化学平衡状态具有逆,等,动,定,变、同等特征。 逆:化学平衡研究的对象是可逆反应。 等:处于密闭体系中的可逆反应,平衡时,正逆反应速率相等,即v正=v逆。(对于同一个物质,v正=v逆数值上相等;对于不同物质,vA正:vB逆=a:b,即等于系数比) 动:平衡时,反应仍在进行,是动态平衡,反应进行到了最大程度。(V正=V逆且都不等于0) 定:达到平衡状态时,反应混合物中各组成成份的(百分)含量保持不变,反应速率保持不变,反应物的转化率保持不变。 变:化学平衡跟所有的动态平衡一样,是有条件的,暂时的,相对的,当条件发生变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建立新平衡。 同:对于一个确定的可逆反应,不管是从反应物开始反应,还是从生成物开始反应,亦或是从反应物和生成物同时开始,只要满足各组分物质浓度相当,都能够达到相同的平衡状态。 · 化学平衡计算的一般思路和方法: · 有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) · (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。 · (2)对于反应物,对于生成物 |
| 宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网免费提供课件、试题、教案、学案、教学反思设计等备课365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载。数百万365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载,无须注册,天天更新! |
|
|
|
|

|
化学中高考列表 |
||||