宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网www.bjtlcd.com化学反应速率影响因素
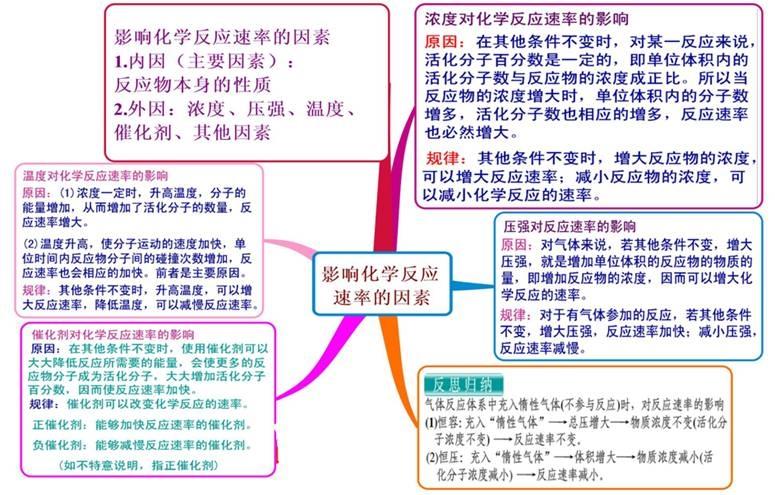
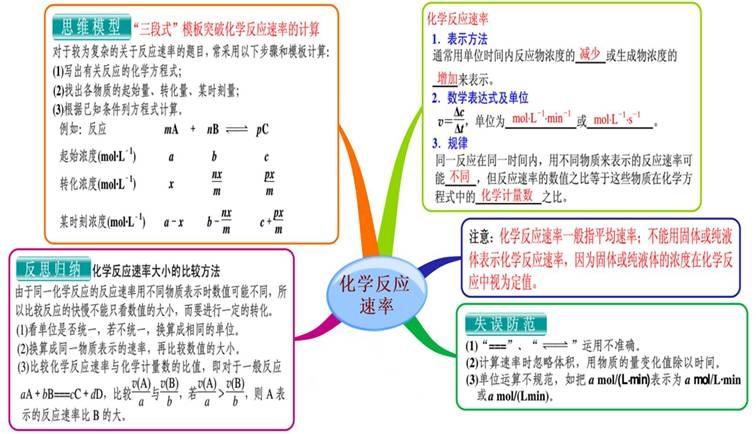
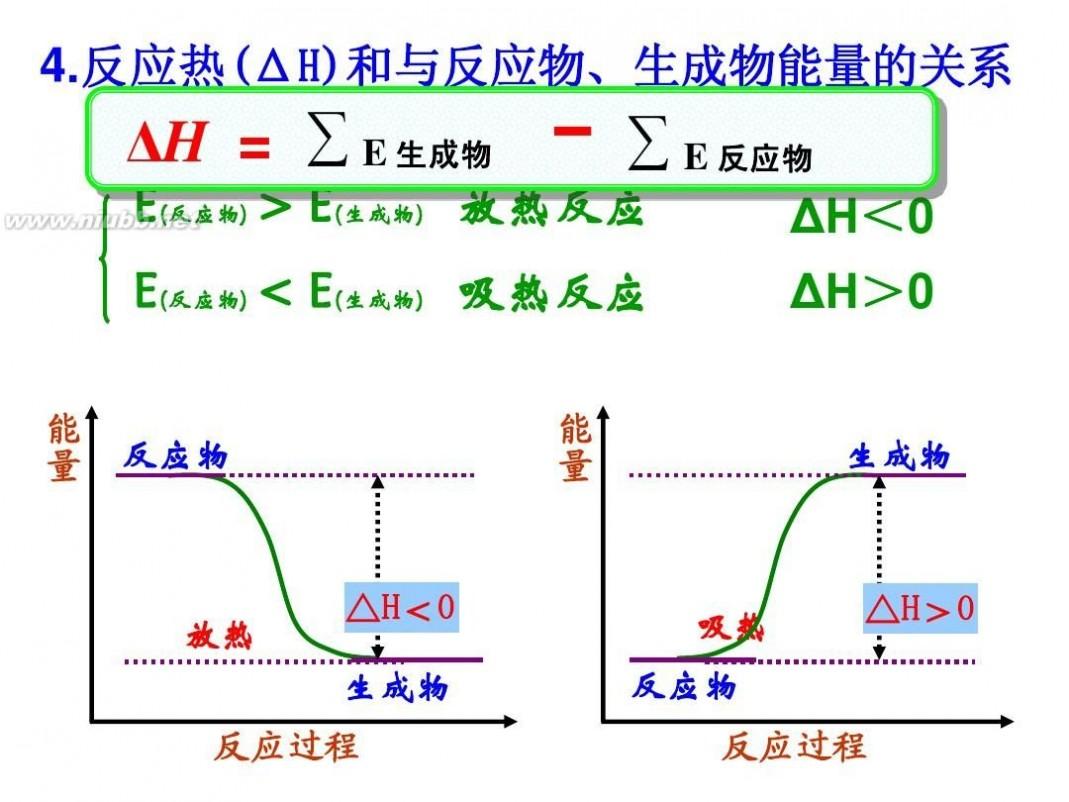
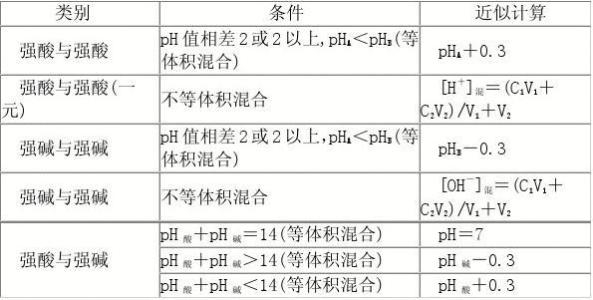
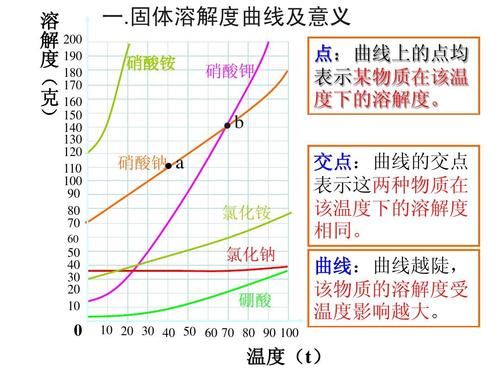
一、内部因素(主要因素): 参加反应物质的性质(化学反应的本质:反应物分子中的化学键断裂、生成物分子中的化学键形成过程(旧键断裂,新键生成) 二、外部因素: 1、压强:对气体来说,若其他条件不变,增大压强,就是增加单位体积的反应物的物质的量,即增加反应物的浓度,因而可以增大化学反应的速率。 规律:对于有气体参加的反应,若其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,反应速率减慢。 2、浓度:在其他条件不变时,增大反应物浓度,可以增大反应速率. 规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;反之,可以减小化学反应速率。 注意:a、此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率;b、一般来说,固体反应物表面积越大,反应速率越大,反之,反应速率越小; c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。 对于气体有下列几种情况: (1)、恒温时:p增大→体积减少→c增大→反应速率增大 (2)、恒容时: A、充入气体反应物→c增大→总压增大→反应速率增大; B、通入“无关气体”(如He、N2等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变; (3)、恒压时:冲入“无关气体”(如He等)→引起体积增大, →各反应物浓度减少→反应速率减慢。 3、温度:反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。 4、催化剂:使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。 注意:(1)、使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间;(2)、没特别指明一般指正催化剂;(3)、催化剂一定的具有选择性;(4)、催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。 5、其他因素:光、固体表面积、溶剂、电磁波、超声波、强磁场、高速研磨、原电池等。 化学反应速率的求算: 首先要熟练掌握化学反应速率的含义,明确中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是等。对于反应,有,利用这一关系,可以很方便地求算出不同物质表示的v的数值: 化学反应速率图像及其应用: 1.物质的量(或浓度)一时间图像及应用此类图像能说明反应体系各组分(或某一组分)在反应过程中的浓度变化情况。如A(g) +B(g)3C(g)的反应情况如图所示, 要注意此类图像各曲线的折点(达平衡)时刻相同,各物质浓度变化符合化学方程式中的计量数关系。例如:某温度时,在恒容(VL)容器中,X、Y、z三种物质的物质的量随时间的变化曲线如下图所示。 根据图像可进行如下计算: (1)计算某物质在O一t3刻的平均反应速率、转化率,如 Y的转化率为. (2)确定化学方程式中各物质的化学计量数之比如X、Y、z三种物质的化学计量数之比为: (n1一n3):(n2一n3):n2。 2.全程速率一时间图像如Zn与足量盐酸的反应,反应速率随时间的变化出现的情况,如图所示, 解释原因:AB段(v增大),因反应为放热反应,随反应的进行,温度升高,导致反应速率增大;BC段(v减小),则主要因为随反应的进行,溶液中 c(H+)减小,导致反应速率减小。故分析时要抓住各阶段的主要矛盾,认真分析。 3.速率一温度(压强)图像这类图像有两种情况:一是不隐含时间变化的速率一温度(压强)图,二是隐含时间变化的速率一温度 (压强)图。以,△H< 0为例,V一T(P)图像如下: 宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网www.bjtlcd.com |
| 宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网免费提供课件、试题、教案、学案、教学反思设计等备课365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载。数百万365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载,无须注册,天天更新! |
|
|
|
|

|
化学中高考列表 |
||||