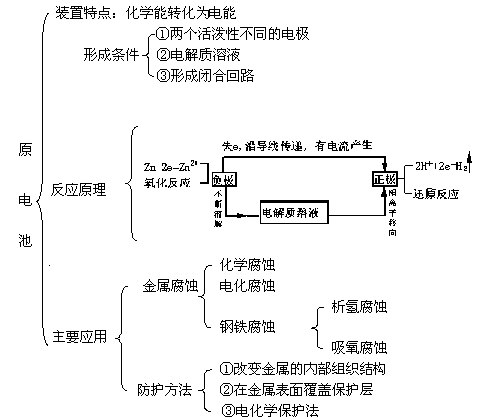
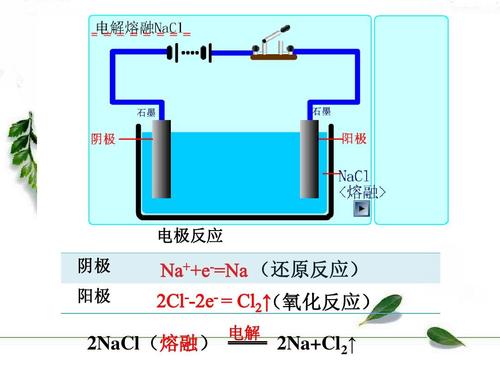
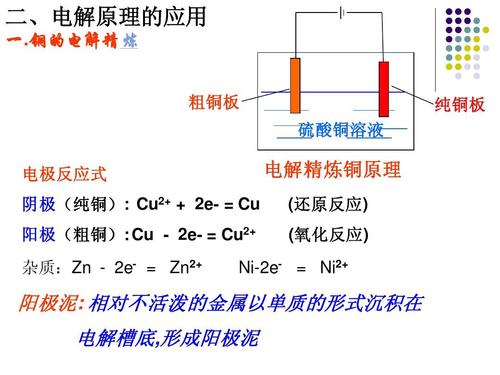
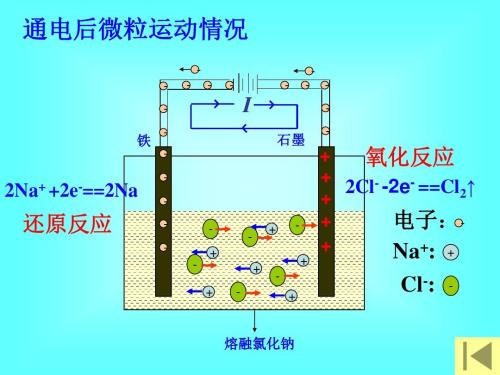
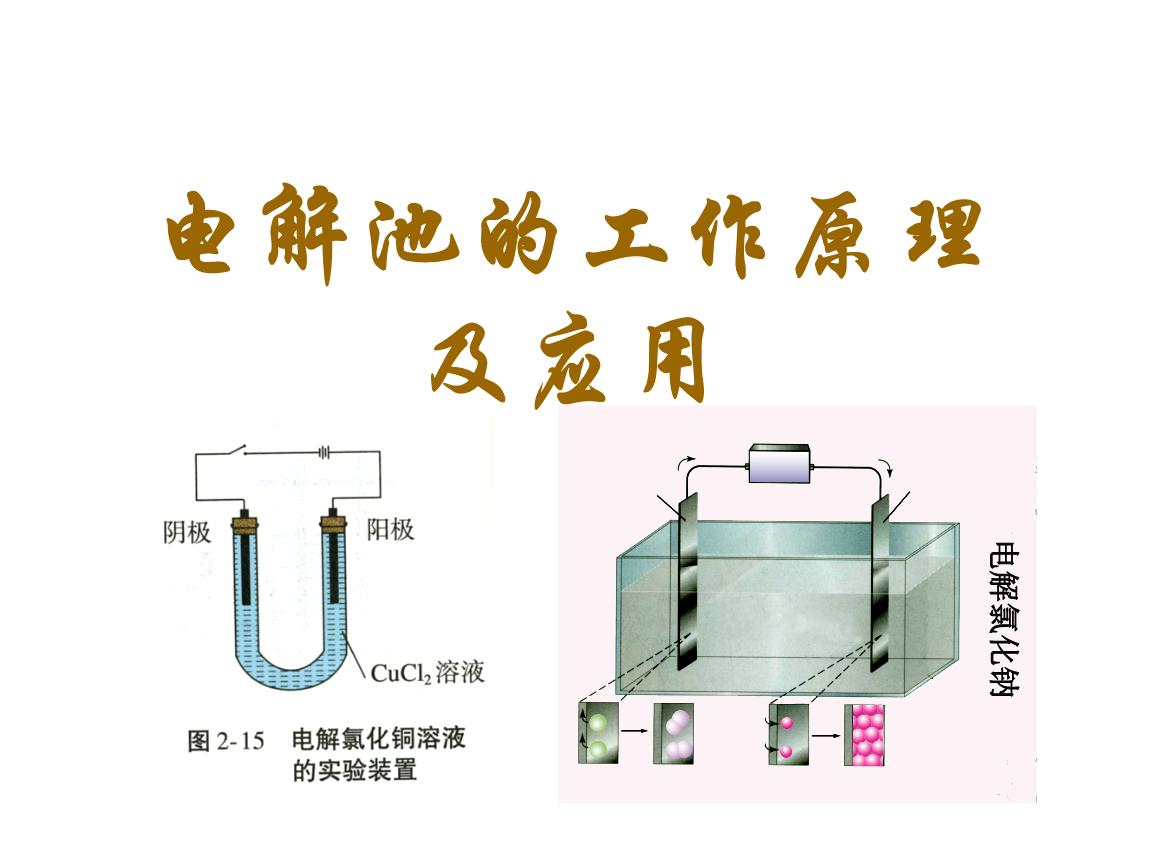
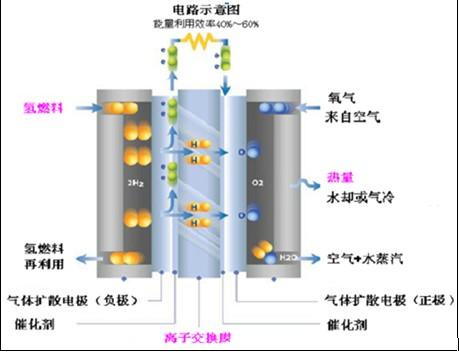
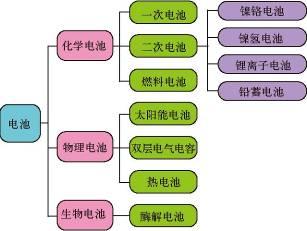
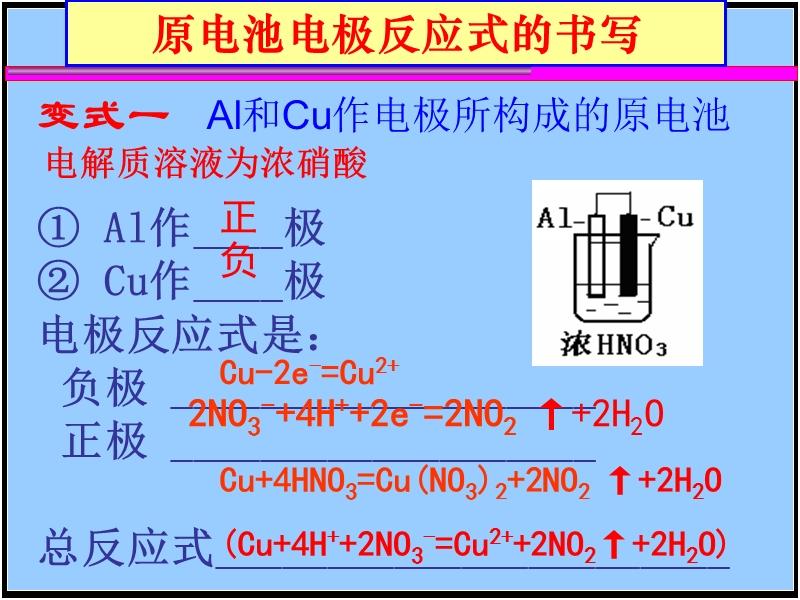
| 宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网www.bjtlcd.com 原电池正负极判断的方法 ①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。 ②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。 ③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。 ④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。 ⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。 ⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。 ⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。 原电池: 1.定义:将化学能转化为电能的装置。 2.工作原理: 以铜-锌原电池 3.实质:化学能转化为电能。 4.构成前提:能自发地发生氧化还原反应。 5.电极反应: 负极:失去电子;氧化反应;流出电子 正极:得到电子;氧化反应;流入电子 原电池中的电荷流动: 在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。 一、原电池的原理 1.构成原电池的四个条件以铜锌原电池为例 ①活拨性不同的两个电极 ②电解质溶液 ③自发的氧化还原反应 ④形成闭合回路 2.原电池正负极的确定 ①活拨性较强的金属作负极,活拨性弱的金属或非金属作正极。 ②负极发生失电子的氧化反应,正极发生得电子的还原反应 ③外电路由金属等导电。在外电路中电子由负极流入正极 ④内电路由电解液导电。在内电路中阳离子移向正极,阴离子会移向负极区。 Cu-Zn原电池:负极: Zn-2e=Zn2+ 正极:2H+ +2e=H2↑ 总反应:Zn +2H+=Zn2+ +H2↑ 氢氧燃料电池,分别以OH和H2SO4作电解质的电极反应如下: 碱作电解质:负极:H2—2e-+2OH-=2 H2O 正极:O2+4e-+2 H2O=4OH- 酸作电解质:负极:H2—2e-=2H+ 正极:O2+4e-+4H+=2 H2O 总反应都是:2H2+ O2=2 H2O 二、电解池的原理 1.构成电解池的四个条件以NaCl的电解为例 ①构成闭合回路 ②电解质溶液 ③两个电极 ④直流电源 2.电解池阴阳极的确定 ①与电源负极相连的一极为阴极,与电源正极相连的一极为阳极 ②电子由电源负极→ 导线→ 电解池的阴极→ 电解液中的被还原,电解池中阴离子被氧化→ 电解池的阳极→导线→电源正极 ③阳离子向负极移动;阴离子向阳极移动 ④阴极上发生阳离子得电子的还原反应,阳极上发生阴离子失电子的氧化反应。 注意:在惰性电极上,各种离子的放电顺序 三.原电池与电解池的比较 原电池电解池 1定义化学能转变成电能的装置电能转变成化学能的装置 2形成条件合适的电极、合适的电解质溶液、形成回路电极、电解质溶液或熔融的电解质、外接电源、形成回路 3电极名称负极正极阳极阴极 4反应类型氧化还原氧化还原 5外电路电子流向负极流出、正极流入阳极流出、阴极流入 四、在惰性电极上,各种离子的放电顺序: 1、放电顺序: 如果阳极是惰性电极Pt、Au、石墨,则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写书写电极反应式。 阴极发生还原反应,阳离子得到电子被还原的顺序为:Ag+>Hg2+>Fe3+>Cu2+>酸电离出的H+>Pb2+>Sn2+>Fe2+>Zn2+>水电离出的H+>Al3+>Mg2+>Na+>Ca2+>+。 阳极惰性电极发生氧化反应,阴离子失去电子被氧化的顺序为:S2->SO32->I->Br ->Cl->OH->水电离的OH->含氧酸根离子>F-。 注:在水溶液中Al3+、Mg2+、Na+、Ca2+、+这些活泼金属阳离子不被还原,这些活泼金属的冶炼往往采用电解无水熔融态盐或氧化物而制得。 2、电解时溶液pH值的变化规律 电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。 ①若电解时阴极上产生H2,阳极上无O2产生,电解后溶液pH值增大; ②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小; ③若阴极上有,阳极上有,且V O2=2 V H2,则有三种情况:a 如果原溶液为中性溶液,则电解后pH值不变;b 如果原溶液是酸溶液,则pH值变小;c 如果原溶液为碱溶液,则pH值变大; ④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶 液CuCl2溶液由于Cu2+水解显酸性,一旦CuCl2全部电解完,pH值会变大,成中性溶液。 3、进行有关电化学计算,如计算电极析出产物的质量或质量比,溶液pH值或推断金属原子量等时,一定要紧紧抓住阴阳极或正负极等电极反应中得失电子数相等这一规律。 五、电解原理的应用 1制取物质:例如用电解饱和食盐水溶液可制取氢气、氯气和烧碱。 2电镀:应用电解原理,在某些金属表面镀上一薄层其它金属或合金的过程。电镀时,镀件作阴极,镀层金属作阳极,选择含有镀层金属阳离子的盐溶液为电解质溶液。电镀过程中该金属阳离子浓度不变。 3精炼铜:以精铜作阴极,粗铜作阳极,以硫酸铜为电解质溶液,阳极粗铜溶解,阴极析出铜,溶液中Cu2+浓度减小 4电冶活泼金属:电解熔融状态的Al2O3、MgCl2、NaCl可得到金属单质。 六、电解举例 1电解质本身:阳离子和阴离子放电能力均强于水电离出H+和OH -。如无氧酸和不活泼金属的无氧酸盐。 ①HClaq:阳极Cl->OH-2Cl――2e-=Cl2↑ 阴极H+ 2H++2e-=H2↑ 总方程式 2HCl H2↑+Cl2↑ ②CuCl2aq:阳极Cl->OH-2Cl――2e-=Cl2↑ 阴极Cu2+>H+ Cu2++2e-=Cu 总方程式 CuCl2 Cu+Cl2↑ 2电解水:阳离子和阴离子放电能力均弱于水电离出H+和OH -。如含氧酸、强碱、活泼金属的含氧酸盐。 ①H2SO4aq:阳极SO42- 总方程式 2H2O 2H2↑+O2↑ ②NaOHaq:阳极OH-4OH――4e-=2H2O+O2↑ 阴极:Na+ 总方程式 2H2O 2H2↑+O2↑ ③Na2SO4aq:阳极SO42- 总方程式 2H2O 2H2↑+O2↑ 3电解水和电解质:阳离子放电能力强于水电离出H+,阴离子放电能力弱于水电离出OH-,如活泼金属的无氧酸盐;阳离子放电能力弱于水电离出H+,阴离子放电能力强于水电离出OH -,如不活泼金属的含氧酸盐。 ①NaClaq:阳极Cl->OH-2Cl――2e-=Cl2↑ 阴极:Na+ 总方程式 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ ②CuSO4aq:阳极SO42-H+ Cu2++2e-=Cu 总方程式 2CuSO4+2H2O 2Cu+2H2SO4+O2↑ |
| 宜城教育365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载网免费提供课件、试题、教案、学案、教学反思设计等备课365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载。数百万365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载,无须注册,天天更新! |
|
|
|
|

|
化学中高考列表 |
||||