盖斯定律计算反应热的注意事项
1.明确所求反应的始态和终态,各物质系数,及反应是吸热还是放热反应。 2.盖斯定律与反应途径无关,不同途径对应的最终结果是一样的。 3.各反应式相加时,有的反应逆向写,ΔH符号也相反。有的反应式要扩大或缩小相应倍数,ΔH也要相应扩大或缩小相同的倍数。 4.注意各分步反应的ΔH的正负,放热反应为“—”,吸热反应为“+”,其具备数学意义,可进行大小比较。 5.注意弱电解质的电离、水解反应吸热,浓硫酸的稀释、氢氧化钠固体的溶解放热,都将对反应热产生影响。 应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。 (2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算 (3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体 (4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热 (5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。 焓变包含于反应热包含于热效应,就相当于热效应是最大的集合。焓是与内能有关的物理量,反应在一定条件下是吸热还是放热由生成物和反应物的焓值差即焓变(△H)决定。等压条件下的反应热等于焓变。 焓变与反应热的含义
焓变即物体焓的变化量。焓是物体的一个热力学能状态函数,即热函,一个系统中的热力作用,等于该系统内能加上其体积与外界作用于该系统的压强的乘积的总和。 反应热是指当一个化学反应在恒压以及不作非膨胀功的情况下发生后,若使生成物的温度回到反应物的起始温度,这时体系所放出或吸收的热量称为反应热。 焓变与反应热的区别
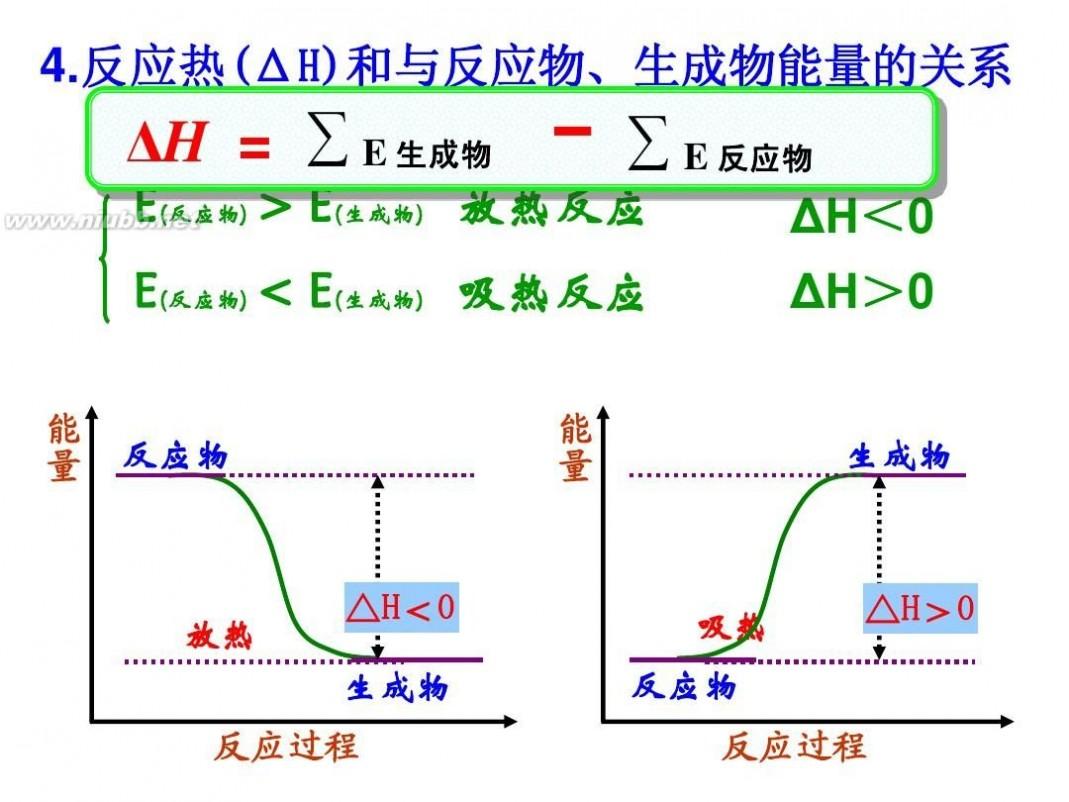
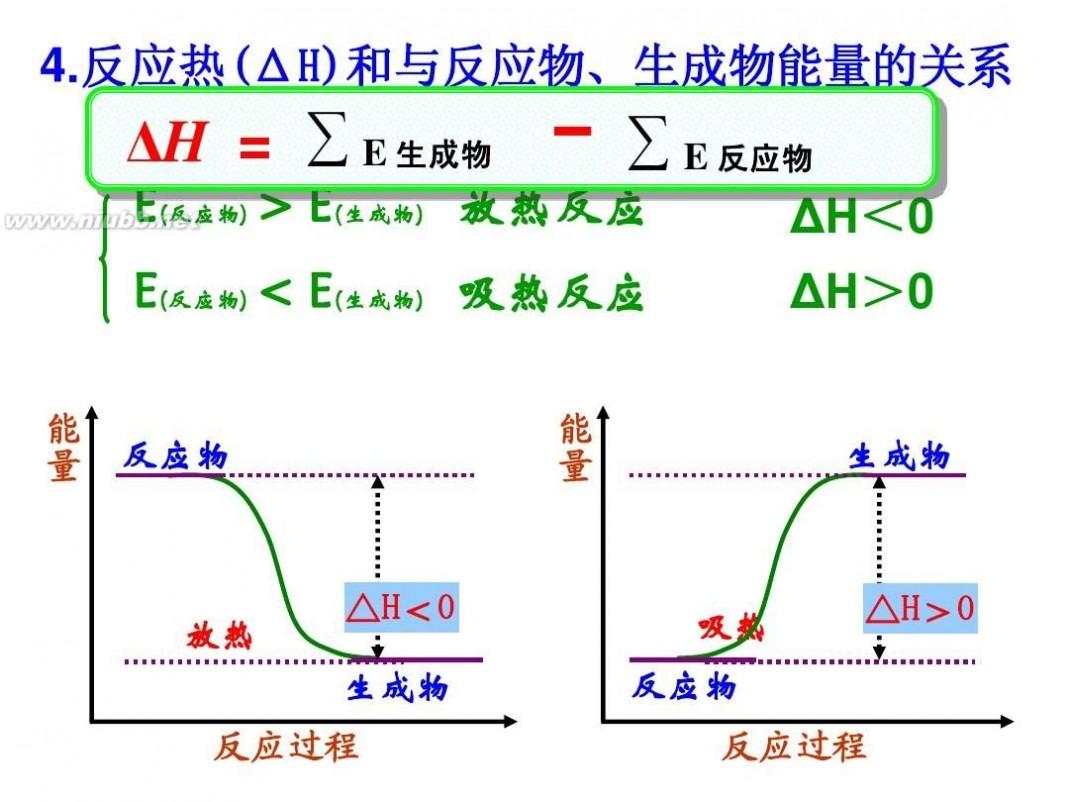
当系统发生了化学反应之后,使反应产物的温度回到反应前始态的温度,系统放出或吸收的热量就称为该反应的热效应,简称反应热,用Q表示。 Q与过程有关,不是状态函数,即使始末状态相同,只要过程不同(如等压过程和等容过程),Q值就不同。 焓是热力学中表示物质系统能量的一个状态函数,用符号H表示,H=U+pV。焓的变化是系统在等压可逆过程中所吸收的热量的度量。 焓是状态函数,它的值只与状态有关而与过程无关。 反应焓变(反应热)的简单计算: 1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。 2.根据反应物和生成物的能量计算 △H生成物的能量总和一反应物的能量总和。 3.根据反应物和生成物的键能计算 △H反应物的总键能-生成物的总踺能。 4.根据盖斯定律计算 将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。 5.根据比热公式进行计算 6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” . 1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2.
|
|
|
|
|
|
|
|
|
-
运行环境: WIN 365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载等级: 免费365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载 开 发 商: 不详 365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载添加: 审核:赝青 录入:赝青