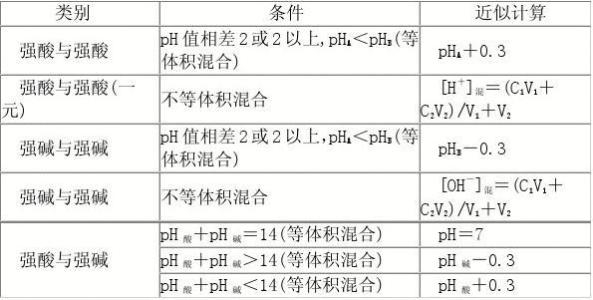
溶液ph的计算方法 溶液PH计算的整体思路是:根据PH的定义PH=-lgc(H+),溶液PH计算的核心是确定溶液中的c(H+)相对大小。 一、单一溶液的PH的计算 若该溶液是酸性溶液,必先确定c(H+),再进行PH的计算。若该溶液是碱性溶液,必先确定c(OH-),可根据c(H+)·c(OH-)=Kw换算成c(H+),再求PH,或引用PH定义,由c(OH-)直接求POH,再根据PH+POH=PKw,换算出PH。 二、溶液稀释后的PH的计算 1、强酸或强碱的稀释 在稀释强酸或强碱时,当它们的浓度大于10-5mol/L时,不考虑水的电离;当它们的浓度小于10-5mol/L时,应考虑水的电离。 2、弱酸或弱碱的稀释 在稀释弱酸或弱碱过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其PH范围。 如PH=3的醋酸溶液,稀释100倍,稀释后3<PH<5;PH=10的氨水,稀释100倍,稀释后8<PH<10;PH=3的酸溶液,稀释100倍,稀释后3<PH≤5;PH=10的碱溶液,稀释100倍,稀释后8≤PH<10。 三、溶液混合后的PH的计算 两种溶液混合后,首先应考虑是否发生化学变化,其次考虑溶液总体积变化,一般来说溶液的体积没有加和性,但稀溶液混合时,常不考虑混合后溶液的体积的变化,而取其体积之和(除非有特殊说明)。 1、两强酸混合后的PH的计算 先求混合后的c(H+)混,再直接求PH。即:c(H+)混=[ c(H+)1×V1+ c(H+)2×V2]/(V1+ V2)。 2、两强碱混合后的PH的计算 先求混合后的c(OH-)混,再间接求PH。即:c(OH-)混=[ c(OH-)1×V1+ c(OH-)2×V2]/(V1+ V2)。 知识拓展——0.3规则(近似规则) 若两种强酸溶液或两种强碱溶液等体积混合,且其PH相差2个或2 个以上时,混合液的PH有如下近似规律: 两强酸等体积混合时,混合液的PH=PH小+0.3; 两强碱等体积混合时,混合液的PH=PH大-0.3。 3、强酸与强碱溶液混合后的PH的计算 根据n(H+)与n(OH-)的相对大小先判断酸、碱的过量情况。 ⑴强酸与强碱恰好完全反应,溶液呈中性,PH=7。 ⑵若酸过量,溶液呈酸性,n(H+)>n(OH-),c(H+)混=[ n(H+)-n(OH-)]/V总。 ⑶若碱过量,溶液呈碱性,n(OH-)>n(H+),c(OH-)混=[ n(OH-)-n(H+)]/V总,再求出c(H+)混。 ⑷若未标明酸碱的强弱,混合后溶液PH不定,应分析讨论。 ①若强酸(PH1)和强碱(PH2)等体积混合,PH1+ PH2=14,则溶液呈中性,PH=7;PH1+ PH2>14,则溶液呈碱性,PH>7;PH1+ PH2<14,则溶液呈酸性,PH<7。 ②若酸(PH1)和碱(PH2)等体积混合,PH1+ PH2=14,若为强酸与强碱,则恰好反应,PH=7;若为弱酸与强碱,则酸有剩余,PH<7;若为强酸与弱碱,则碱有剩余,PH>7。 注意:在相关计算过程中,应遵守“酸按酸,碱按碱,同强混合在之间,异强混合看过量”。 溶液pH的计算方法: 总体原则 (1)若溶液为酸性,先求C(H+),再求pH; (2)若溶液为碱性,先求C(OH-),再由,最后求pH。 1.单一溶液pH的计算 (1)强酸溶液,如溶液,设溶质的物质的量浓度为 (2)强碱溶液,如溶液,设溶质的物质的量浓度为 2.两强酸混合后pH的计算 由先求出混△后的再根据公式求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。 3.两强碱混合后pH的计算 由先求出混台后的再通过 4.强酸与强碱混合后pH的计算 强酸与强碱混合的实质是中和反应即中和后溶液的pH有以下几种情况: (1)若恰好中和,pH=7。 (2)若剩余酸,先求中和后的c(H+),再求pH。 (3)若剩余碱,先求中和后的c(OH-),再通过求出最后求pH. 注意:强酸与强碱等体积混合后溶液酸碱性的判断规律: ①若二者pH之和为14,则混合后的溶液呈中性, pH=7 ②若二者pH之和大于14,则混合后的溶液呈碱性 ③若二者pH之和小于14,则混合后的溶液呈酸性, 5.溶液稀释后求pH (1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。 (2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。 例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7); pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7): pH=3的HCl溶液稀释100倍,溶液pH=5; pH=10的NaOH溶液稀释100倍,溶液pH=8。 注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。 |
|
|
|
|
|
|
|
|
-
运行环境: WIN 365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载等级: 免费365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载 开 发 商: 不详 365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载添加: 审核:赝青 录入:赝青