溶解度的计算公式
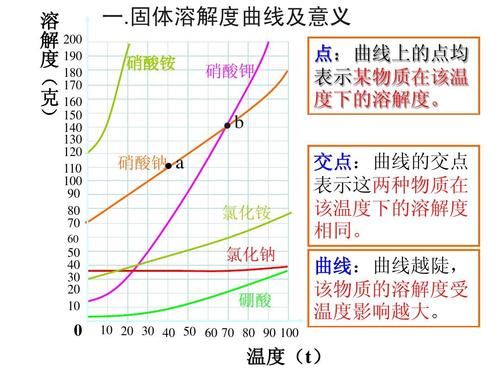
1.在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。溶解度(g)=饱和溶液中溶质的质量(g)/饱和溶液中溶剂的质量(g)×100%。 2.物质溶解与否,溶解能力的大小,一方面决定于物质(指的是溶剂和溶质)的本性;另一方面也与外界条件如温度、压强、溶剂种类等有关。在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。 3.通常把某一物质溶解在另一物质里的能力称为溶解性。例如,糖易溶于水,而油脂不溶于水,就是它们对水的溶解性不同。溶解度是溶解性的定量表示。 4.溶解度与温度有关,会因温度而变化,一般是温度越高,溶解度越大。也有相反的,如氢氧化钙,在水中的溶解度就会随着温度升高而降低。 溶解度的计算: 溶解度的计算公式:S=100m质/m剂(一定温度下的饱和溶液) 溶解度曲线: 在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。 ①表示意义 a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况; b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度; c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度; d.曲线下方的点表示溶液是不饱和溶液; e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。 ②溶解度曲线的变化规律 a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3; b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。 c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2 ③应用 a.根据溶解度曲线可以查出某物质在一定温度下的溶解度; b.可以比较不同物质在同一温度下的溶解度大小; c.可以知道某物质的溶解度随温度的变化情况; d.可以选择对混合物进行分离或提纯的方法; e.确定如何制得某温度时某物质的饱和溶液的方法等。 运用溶解度曲线判断混合物分离、提纯的方法: 根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图) (1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。 具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。 (2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。 具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。 |
|
|
|
|
|
|
|
|
-
运行环境: WIN 365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载等级: 免费365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载 开 发 商: 不详 365速发国际靠谱么_365bet亚洲官方网址_预付365商城下载添加: 审核:赝青 录入:赝青